FORMAS DA DOENÇA FLCIFORME
| Hb A1
| HbA2
| Hb F
| Hb C
| Hb S
|
SS
| 0
| < 3.5
| 2 – 20%
| 0
| 80 – 95%
|
SC
| 0
| -
| 1 – 5%
| 45 – 50%
| 45 – 50%
|
S beta
| 0
| 3.5 – 7%
| 2 – 15%
| 0
| 80 – 92%
|
S beta+o
| 5 – 30%
| 3.5 - 6%
| 2 – 10%
| 0
| 65 – 90%
|
AS – traço
| 50 – 60%
| <3.5%
| <2%
| 0
| 35 – 45%
|
Normal
| 95 – 98%
| <3.5%
| <2%
| 0
| 0
|
Outras formas mistas: S –D; S – E; S – lepore; S – quebec - chori
ASPECTOS GERAIS
A Anemia Falciforme tem origem desconhecida, mas provavelmente desenvolveu-se na África, milhões de anos atrás. Protege as pessoas contra malária, doença comum e séria nos países de clima quente.
No Brasil estima-se que 3 de cada 100 pessoas são portadoras de traço de Anemia Falciforme e 1 em cada 500 negros brasileiros nasce com uma da doença
Embora haja uma incidência na raça negra, os brancos, particularmente os que são provenientes do mediterrâneo ( Grécia, Itália, etc. ) Oriente médio, Índia, apresenta, doenças.
Diante deste quadro é possível deduzir-se que a miscigenação racial no Brasil está gerando a continuidade desta anemia, conforme ratifica a literatura brasileira, apontando de forma contundente que anemias hereditárias no país constituem um grave problema de saúde publica.
A DOENÇA
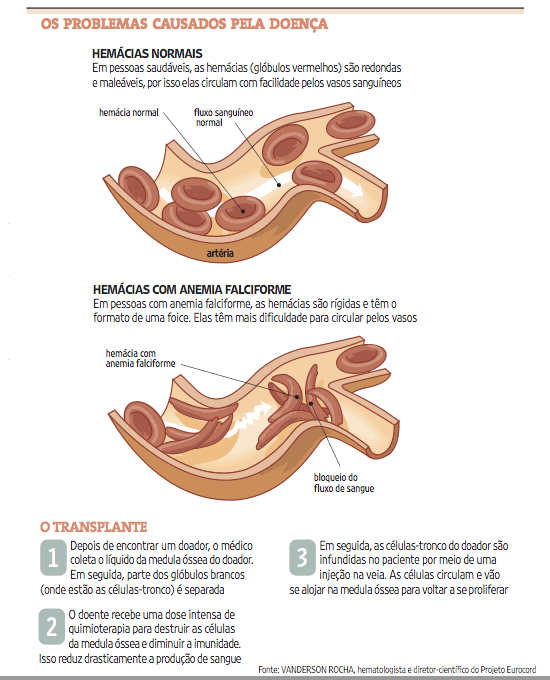
A doença Falciforme é doença genética e hereditária, causada por anormalidade de hemoglobina dos glóbulos vermelhos do sangue, responsáveis pela retirada do oxigênio dos pulmões, transportando-o para os tecidos. Esses glóbulos vermelhos perdem a forma discóide, enrijecem-se e deformam-se, tomando a forma de " FOICE ". Os glóbulos deformados, alongados, nem sempre conseguem passar através de pequenos vasos, bloqueando –os e impedindo a circulação do sangue nas áreas ao redor. Como resultado causa dano ao tecido circunvizinho e provoca dor. O curso da doença é variável. Há doentes que apresentam problemas com mais freqüência e outros têm problemas esporádicos de saúde.
Geralmente é durante a Segunda metade do primeiro ano de vida de uma criança que aparecem os primeiros sintomas da doença. Exceção é feita nos casos onde o exame de sangue – para detecção da doença – foi realizado já no nascimento ou no berçário. Até atingir a idade escolar é comum a doença se manifestar, é raro isso não ocorrer.
A Anemia Falciforme não deve ser confundida com o traço falciforme. Traço falciforme significa que a pessoa é tão somente portadora da doença, com vida social normal.
O defeito genético constitui basicamente a substituição do Ácido Glutâmico pela Valina na posição seis da cadeia beta da hemoglobina.
PADRÃO DE HEREDITARIEDADE
A forma comum da Anemia Falciforme ( Hbss ) acontece quando uma criança herda um gene da hemoglobina falciforme da mãe ou do pai . É necessário que cada um dos pais tenha pelo menos um gene falciforme, o que significa, que cada um é portador de um gene da hemoglobina falciforme e um gene da hemoglobina nomal.
Como a condição de portador do traço falciforme é um estado benigno, muitas pessoas não estão cientes de que o possuem. Quando duas pessoas portadoras do traço falciforme resolvem ter filhos, é importante que saibam que para cada gestação há possibilidade de um para quatro de que a criança tenha doença falciforme ; há possibilidade de uma em duas de que a criança tenha o traço da hemoglobina e a chance de um em quatro de que tenha a hemoglobina normal.
O traço falciforme não é uma doença. Significa que a pessoa herdou de seus pais a hemoglobina ( A ) e ( S ). Como recebeu um tipo do pai e outro da mãe é ( AS ).
È importante saber: filhos de duas pessoas com traço falciforme podem nascer com anemia falciforme, daí a importância de fazer exames.
- 25% normal (AA)
- 50% traço falciforme ( AS)
- 25% de anemia falciforme ( SS )
PROBABILIDADE GENÉTICA
Para pais ( AS)
- 25% NORMAL ( AA )
- 50% DE TRAÇO FALCIFORME ( AS )
- 25% de anemia falciforme ( SS )
Para pais (AS) * ( SS )
- 50% DE TRAÇO FALCIFORME (AS )
- 50% DE ANEMIA FALCIFORME ( SS )
Para pais ( SS)
- 100% DE ANEMIA FALCIFORME
Para pais ( AS) * ( AA)
- 50% NORMAL (AA )
- 50% DE TRAÇO FALCIFORME ( AS )
Para pais (AA ) * ( SS )
FORMAS CLÍNICAS
Embora todo o paciente com anemia falciforme apresente a mesma mutação genética, a diversidade relativa à severidade das manifestações clínicas é notável.
Vários fatores modificantes vem sendo estudados com o intuito de definir o porquê dessa diversidade. Os mais importantes atualmente são: os níveis de Hemoglobina fetal (Hb F ), a coexistência de outras hemoglobinopatias hereditárias ( ex: talassemias ) e finalmente haplótipos para a Hb S.
Os níveis de hemoglobina fetal correspondem a menos de um por cento da hemoglobina total em indivíduos maiores de um ano de idade, porém há casos onde eles se encontram bem mais elevados devido a fatores hereditários, Esses indivíduos apresentam menor severidade dam anemia falciforme, já que as moléculas de Hb F não participam do processo de polimerização que ocorre entre as moléculas de hemoglobina S desoxigenada ( desoxi Hb S ).
A associação da doença falciforme com outras hemoglobinas hereditárias é relativamente freqüente e leva a uma diversidade de quadros clínicos, que variam desde formas assintomáticas até as mais severas. Seus mais comuns são;
1
| Anemia falciforme ( doença SS ), onde os indivíduos são homozigotos para o gene da hemoglobina S
|
2
| Traço falcifome (doenças AS ), onde o paciente possui um gene que sintetiza cadeias polipeptídicas globínicas normais ( Bª ) e um gene anormal ( Bs ), com produção de ambas as hemoglobinas (A e S ), predominando a hemoglobina A (Hb A ). Seus eritrócitos só falcilizam sob circunstância específicas como hipóxia severa, ou ao passar pela medula renal, causando hipostenúria.
|
3
| Eritrofalcemia associada a beta talassemia
S beta o Thal: não há produção de hemoglobina beta pelo gene da beta talassemia
S beta + Thal: O indivíduo produz cadeias beta normais porém em pequenas quantidades
|
4
| Eritrofalcemia associada a hemoglobina C, onde o paciente possui dois genes de cadeias beta alterados ( B s e B c ), o que faz com que haja a produção tanto de Hb S quanto de Hb C
|

Os últimos fatores moduladores conhecidos atualmente são os haplótipos da Hb S, que podem ser descritos como sítios polimórficos de endunocleases de restrição, localizados no interior e ao redor do gene da cadeia beta mutante designados de acordo com a área geográfica onde foram primeiramente identificados: Senegal, Benin, CAR ( "CENTRAL AFRICANA REPUBLIC" OU BANTU ) e Asiático ( INDU ARÁBICO ). Foi descrito também o haplótipo Cameroon, localizado apenas em um único grupo étnico na República dos Camarões.
Na América, os haplótipos mais comuns são: Senegal, Benin e CAR. Pacientes com o haplótipo Senegal, geralmente, apresentam formas clínicas mais brandas, enquanto aqueles com haplótipos CAR as mais severas. Pacientes com haplótipo Benin apresentam formas com gravidade intermediária.
O mecanismo pelo qual cada haplótipo influencia na severidade da doença permanece um mistério. Experiências comprovam que cada um deles possui níveis diferentes de hemoglobina fetal. Os pacientes com o haplótipo Senegal, por exemplo, apresentam mais de 205 de Hb F.
Os haplótipos representam uma área relativamente nova de investigação a respeito da variação da doença falciforme. Seus mecanismos ainda não foram bem caracterizados e atualmente , os antropologistas os utilizam para trançar a migração dos genes da anemia falciforme da África para o Mediterrâneo e para o continente americano.
FISIOPATOLOGIA:
Quando a hemoglobina S é desoxigenada, a substituição do ácido glutâmico pela valina na posição seis da cadeia beta resulta numa interação hidrofóbica com outras moléculas de hemoglobina, desencadeando uma agregação em grandes polímeros
A polimerização da hemoglobina S desoxigenada é o evento primário na patogênese molecular da doença falciforme, resultando na distorção da forma da hemácia e diminuição acentuada da sua capacidade de se deformar.
Após ser repetidamente submetida a afoiçamento na micro circulação as célula pode perder a capacidade de retornar a sua forma discóide bicôncava normal. Esses eritrócitos siclêmicos irreversíveis provavelmente resultam da perda ou do enrijecimento de porções da membrana a medida em que o citoesqueleto da membrana eritrocitária é danificado. Afoiçamento repetidos podem também levar a formação de inclusões com características morfológicas de pequenos corpúsculos de Heinz. Essas inclusões se ligam a membrana e são parcialmente responsáveis pela destruição prematura dessas hemácias.
O fenômeno de afoiçamento dos eritrócitos e responsável por todo o quadro fisiopatológico apresentado pêlos pacientes com anemia falciforme.
DIAGNÓSTICO LABORATORIAL
O diagnóstico de anemia falciforme deve ser considerado, principalmente em pacientes de cor negra que se apresentem com anemia hemolítica.
Inicialmente, pode –se lançar mão de um exame inespecífico como o hemograma, que normalmente revela anemia na maioria das vezes normocrômica e normocítica ( podendo ser hipócrônoca e eventualmente macrocítica ), além de sinais indiretos de hemólise caracterizados por hiperbilirrubinemia indireta e retilocitose. Leucocitose com neutrofilia moderada não necessariamente relacionada a infecção e tyrombocitose completam o quadro hematológico, notadamente durante as crises vaso-oclusivas. Plaquetopenia pode ocorrer em quadros de seqüestro esplênico.
O esfregaço de sangue periféricos também é bastante útil, podendo apresentar anisopoiquilocitose e policromasia.
É a eletroforese de hemoglobina que estabelece o diagnóstico. Pacientes com anemia falciforme ( homozigotas ) apresentam cerca de 2 a 20% de Hb F e 2 a 4% de Hb A2. O restante é Hb S. A Hb A não é detectada a menos que o paciente tenha sido transfundido nos últimos 4 meses.
QUADROS ASSOCIADOS
ANEMIA HEMOLÍTICA
Anemia normocrômica moderada ou grave está presente durante toda a vida do paciente com doença falciforme. Ela resulta do defeito intra-corpuscular que acelera a destruição eritrocitária, independente da idade das células. Como conseqüência há hipératividade medular compensatória com hiperplasia do setor eritropoiético. Ocorre também o aumento da bilirrubina indireta na sangue periférico e consequentemente icterícia.
O equilíbrio entre esta destruição das hemácias e a resposta compensatória eritropoiética medular permite que os pacientes se adaptem as cifras hematimétricas toleráveis e compatíveis com as atividades diárias.
As crises hemolíticas representam o agravamento súbito do fenômeno de hemólise sendo raras e freqüentemente associadas a fatores precipitantes como infecções, deficiências de G6PD, hipóxia, desidratação e seqüestro esplênico.
A causa mais freqüente de agravamento da anemia é decorrente de insuficiência medular geralmente associado a infecções, comprometendo o precário equilíbrio que existe entre a destruição eritrocitária aumentada na circulação periférica e a tentativa de compensação efetuada pela medula óssea em resposta a hipóxia e traduzida citologicamente pela hiperplasia eritróide. O exemplo mais dramático de bloqueio na compensação medular é a crise aplastica secundária à infecção pelo parvovírus B 19.
Transfusões sangüíneas podem ser vitais quando ocorre o desenvolvimento de anemia severa sintomática, sendo recomendadas em pacientes que apresentam dispnéia grave, taquicardia intensa, e astenia incapacitante entre outros sinais clínicos de gravidade. Normalmente administra-se ácido fólico para esses pacientes.
CRISES ÁLGICAS
São ocasionadas pela injúria isquêmica tecidual resultante da obstrução do fluxo sangüíneo pelas hemácias afoiçadas. A dimiuição do fluxo sangüínea leva a hipóxia regional e acidose que intensifica o afoiçamento.
Essas crises podem ser desencadeadas por: hipóxia, febre, acidose, desidratação ( as hemácias se desidratam e falcilizam ), menstruação, apnéia do sono e exposição ao frio. Eventualmente os pacientes relatam como fator desencadeante ansiedade, depressão e exaustão física. Porém, em grande parte dos casos não é possível identificar o evento precipitante. A freqüência e a severidade das crises variam de paciente para paciente, assim como seu tempo de duração.
O fenômeno álgico, as vezes de grande intensidade, se manifesta em geral por dor músculo-esquelética, torácica ou abdominal, podendo todavia se originar em qualquer tecido, sendo necessário estabelecer seu diagnóstico diferencial com outras causas de dor, ligadas ou não a hemoglobinopatia S.
As crises dolorosas em geral representam a medida de severidade da doença e têm se correlacionado com a incidência de morte precoce no adulto.
O tratamento da crise álgica deve ser iniciado o mais rápido possível evitando o desgaste física e mental do paciente em decorrência de dor intensa persistente. Além das medidas para este alívio, o combate aos fatores precipitantes também devem ser realizado.
Estudos recentes demonstram que casos de dor leve a moderada respondem com grande melhora quando o tratamento é feito em casa com analgesia oral, aumento da ingesta hídrica, aquecimento, repouso e massagem local. Os pacientes devem ser orientados a iniciarem a analgesia com paracetamol. Em caso de persistência de dor, o uso de antiflatatórios não esteróides, seguido de fosfato de codeína pode levar a regressão do quadro álgico. Caso contrário, a hospitalização para o uso de opióides mais potentes se faz necessário.
INFECÇÕES:
Infecções severas são a maior causa de mortalidade e morbilidade nos pacientes com anemia falciforme . Os sítios mais comuns de infecção são pulmões, o trato gênito urinário, sistema nervoso central, ossos e articulações. Em crianças, são comuns as septicemias e meningites por microorganismos encapsulados, como o Streptococcus pneumoniae por organismos estéricos e Staphilococcus aureus. È comum também a ocorrência de osteomielite por Salmonella sp. Hà diversas razões possíveis para essa propensão acentuada:
1
| Atividade fagocitária alterada do sistema reticuloendotelial, principalmente em crianças com hipoesplenismo funcional.
|
2
| Vaso oclusão dificultando a chegada de leucócitos até a área isquêmica
|
3
| Deficiência de opsonização, por alterações na atividade de fixação da partícula C3 do sistema complemento
|
4
| Deficiência na de granulação de leucócitos polimorfonucleares
|
Crianças com anemia falciforme aparentemente não possuem maior susceptividade a infecções virais, mas estas predispõem a criança a infecção bacteriana subsequente. Devemos lembrar porém que a infecção pelo Parvovírus B19 é a principal causa de crise aplástica no paciente com doença falciforme. O vírus infecta eritroblasto em desenvolvimento, causando parada na produção de eritrócitos por1 ou 2 semanas. Em conseqüência, a concentração de hemoglobina cai drasticamente, podendo resultar em insuficiência cardíaca cogestiva ou em óbito por anemia aguda.
Toda criança com doença falciforme que venha a apresentar febre ( 38,5 Celsius) deve ser tratada tendo em vista a possibilidade de septicemia.
Recomenda-se a internação da criança e realização de hemoculturas e culturas de nasofaringe (procurando colonizando por S.pneumoniae e possível identificação de cepas resistentes).
Imediatamente deve ser iniciada antibioticoterapia empíricautilizando-se por exemplo Ampicilina ou Amoxacilina. Estudos evidenciam a Ceftriaxona como antibiótico ideal para a maioria das infecções bacterianas na anemia falciforme.
Crianças com doenças SS têm resposta imunológica normal a vacinas, sendo estas armas importantes na profilaxia das imfecções na infância. Apesar de apresentar eficácia limitada para determinados sorotipos e em crianças menores de 4 anos, a vacinação conta Pneumococos representou grande avanço na proteção da criança com anemia falciforme, assim como a vacinação contra Haemophilus. É interessante também que a criança falcêmica seja submetida a imunização contra Vírus da Hepatite B, devido ao risco elevado dessa infecção relacionado as freqüentes hemotransfusões. Tabela 2.